Tin tức
GMP Và CGMP Là Gì? So Sánh Khác Biệt Giữa GMP Vs CGMP?
cGMP VÀ NHỮNG ĐIỀU KHÔNG PHẢI AI CŨNG BIẾT
cGMP là gì?
cGMP (Current Good Manufacturing Practice) đề cập đến các quy định thực hành tốt sản xuất hiện tại thực thi bởi FDA (Food and Drug Administration – Cục quản lý thực phẩm và dược phẩm Hoa Kỳ). CGMPs cung cấp cho các hệ thống đảm bảo thiết kế hợp lý, giám sát và kiểm soát các quá trình và các phương tiện sản xuất. Việc tuân thủ các quy định CGMP đảm bảo bản sắc, sức mạnh, chất lượng và độ tinh khiết của sản phẩm thuốc bằng cách yêu cầu các nhà sản xuất thuốc kiểm soát đầy đủ các hoạt động sản xuất. Điều này bao gồm việc thiết lập hệ thống quản lý chất lượng mạnh mẽ, thu thập nguyên liệu chất lượng phù hợp, xây dựng quy trình vận hành mạnh mẽ, phát hiện và điều tra sai lệch chất lượng sản phẩm, duy trì các phòng thí nghiệm thử nghiệm đáng tin cậy.

Tại sao cGMP rất quan trọng?
Hãy cùng Thành Partner phân tích tầm quan trọng của cGMP nhé!
Một người tiêu dùng thường không thể phát hiện (thông qua khứu giác, xúc giác, thị giác) rằng một sản phẩm thuốc có an toàn hay tác dụng phụ.
Theo các yêu cầu thông thường thì thử nghiệm một mẫu thử là không đủ để đảm bảo chất lượng – Hầu hết các trường hợp, việc kiểm tra được thực hiện trên một mẫu nhỏ của mỗi đợt (ví dụ: nhà sản xuất thuốc có thể kiểm tra 100 viên từ một lô có chứa 2 triệu viên).
Do đó, điều quan trọng là thuốc được sản xuất theo các điều kiện và thông lệ theo quy định của cGMP để đảm bảo rằng chất lượng được xây dựng trong quy trình thiết kế và sản xuất ở mọi bước. Các cơ sở trong tình trạng tốt, thiết bị được bảo trì và hiệu chuẩn đúng cách, nhân viên có trình độ và được đào tạo đầy đủ, và các quy trình đáng tin cậy và có thể tái sản xuất, là một vài ví dụ về cách các yêu cầu cGMP giúp đảm bảo an toàn và hiệu quả của các sản phẩm thuốc.

Những Quy Định cGMP nhà máy sản xuất dược phải tuân thủ?
Code of Federal Regulations (CFR – Quy định liên bang)
Các quy định liên quan(CFR) đến cGMP trong các công ty dược phẩm và công nghệ sinh học là:
Mục 21 phần 210 (CFR): Thực hành sản xuất tốt hiện nay trong chế biến sản xuất, đóng gói hoặc bảo quản thuốc.
Mục 21 phần 314 và phần 600 (CFR):Yêu cầu nộp đơn và cấp giấy phép cho người nộp đơn thuốc.
Mục 21 phần 211: Thực hành sản xuất tốt hiện nay cho dược phẩm thành phẩm.

Làm thế nào để FDA xác định một công ty tuân thủ các quy định cGMP hay không?
FDA kiểm tra cơ sở sản xuất dược phẩm trên toàn thế giới, bao gồm cả cơ sở vật chất sản xuất hoạt chất và thành phẩm.
Các nhân viên của FDA đã được đào tạo chuyên sâu theo sát những cơ sở sản xuất này theo đúng chuẩn quy định của FDA.FDA cũng dựa vào các báo cáo về các sản phẩm thuốc có khả năng bị lỗi đã được công bố và ngành sản xuất thuốc.FDA thường sẽ sử dụng các báo cáo này để xác định các trang web cần kiểm tra hoặc điều tra.
Hầu hết các công ty sản xuất dược phẩm được kiểm tra bởi FDA tuân thủ đầy đủ các quy định cGMP.

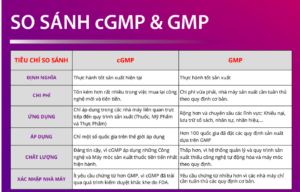
SO SÁNH cGMP và GMP
1. Định nghĩa
– GMP (Good Manufacturing Practice) là thực hành tốt sản xuất theo các quy định của WHO (Tổ chức Y Tế Thế giới)
– cGMP (Current Good Manufacturing Practice) là thực hành tốt sản xuất hiện tại được thực thi bởi FDA (Cục quản lý thực phẩm và dược phẩm Hoa Kỳ)
2. Tính Ứng Dụng
Tính ứng dụng của chứng nhận GMP rộng hơn rất nhiều so với cGMP vì cGMP sử dụng máy móc, thiết bị, công nghệ mới nhất hiện tại nên sẽ mất rất nhiều chi phí.
3. Áp Dụng
GMP đang được sử dụng rộng rãi hơn 100 quốc gia trên thế giới. Tuy nhiên chỉ có một vài thành phố ở Mỹ và quốc gia thuộc Châu Âu, Taiwan đạt chứng nhận cGMP.
4. Chi Phí
cGMP chi phí cao hơn rất nhiều vì tuân thủ các quy định cGMP phải thay đổi toàn bộ máy móc, quy trình, công nghệ mới nhất hiện tại.
5. Chất Lượng Sản Phẩm
Chất lượng sản phẩm dù là nguyên liệu hay thành phẩm đầu ra của thuốc, cGMP đáng tin cậy hơn rất nhiều vì FDA kiểm soát chặt sẽ từ đầu vào, quy trình sản xuất đến đầu ra.
Nguồn: www.robinsonpharma.com, fda.gov


